最初的新药临床试验申请 (IND) 或临床试验申请 (CTA)、新药上市申请 (NDA)、生物制剂许可证申请 (BLA)、上市许可申请 (MAA) 或其他上市申请的提交是一项艰巨的任务。庞大而多样化的团队、众多工具、计划和流程必须协调一致才能取得成功。复杂性、风险、时间和成本是每次监管提交都要面临的问题。如果不认真规划、执行或没有应对意外挑战的能力,您的提交可能会失败。
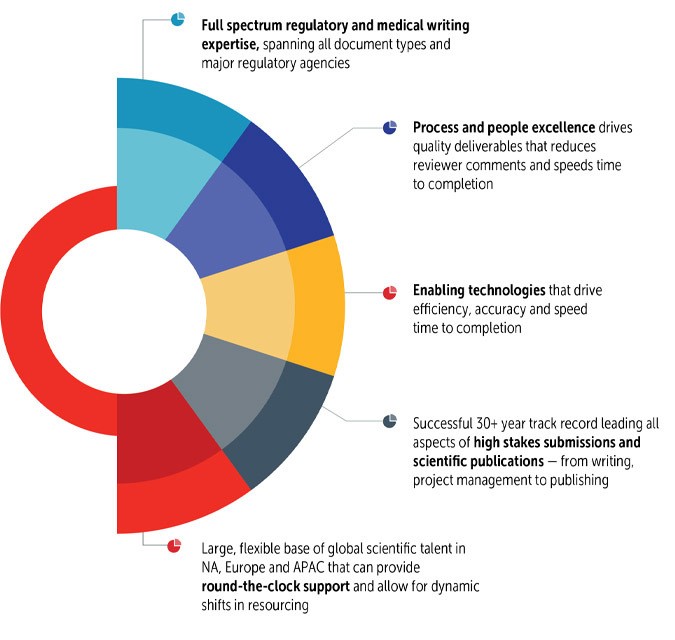
Certara 机构专门的申报负责人拥有丰富的经验,可为客户提供建议并领导项目进行申报和审批,使您的申报工作步入正轨。我们的申报负责人都在生物制药公司担任过重要的申报领导职务,拥有 20 年以上的工作经验。我们拥有超过 200 名专家项目经理、法规撰写人、编辑和出版商,为他们提供支持,使我们能够为您的产品和投稿建立合适的团队。
“现在你们可能已经看到了 FDA 接受我们 NDA 申请的公告。我只想说,感谢你们每个人以及帮助我们走到这一步的 Certara 的所有人。接下来还有更多的事情要做,但这对我们来说是一件大事,对患者来说也是一件大事。没有你们,我们不可能做到这一点。” - 某生物制药公司项目管理副总裁
可靠的申报专业知识以及良好的成功记录
- 超过 96% 的 300+ 份申请获得审批
- 在过去五年的 252 项监管申报中,按时或提前提交的占了 100%
- 现在每年支持超过 50 份申请,涵盖所有申请类型、治疗领域、产品类型和地区
- 擅长设计、规划和交付日益加快的稿件递交时间表,并进行并行撰写
- 加快、紧急使用授权、快速通道、PRIME 和突破性疗法认定
- 在罕见病/孤儿药申报方面具有丰富经验(过去 5 年中有 64 次)
- 全球申报准备工作和领导力专注于纳入区域法规要求
- 在美国、欧盟和加拿大同步递交材料的规划、战略和交付方面的专业知识
- 在大多数主要市场以及南美、非洲和东欧领导成功递交申请的经验
作为重要的意见领袖,Certara 的投稿负责人定期在 DIA 年度会议和 AMWA 的医学撰写与交流会议等主要行业活动上发言。
监管写作以加快您的申报
有关监管写作和医学写作,我们的高素质作家团队包括拥有所有职能领域(文件质量、CMC、非临床、临床和监管)背景的博士、医学博士、药学博士、科学家和护士。
业界一流的 SOP 可提高质量,而专门的 QC 功能和整合的编写团队可减少审核员的意见,加快完成工作的速度。
监管申报指导
我们的递交领导和项目经理都是应用项目规划和管理工具的专家,可利用最先进的 SmartSheet 时间表和内容计划工具跟踪和报告进度,加快并确保成功交付。
- 尽早创建整体信息交流(包括标签、梗概说明和项目风格指南)可确保整个提交过程中的一致性
- 有关以最佳方式向监管机构展示产品和数据的指南
- 支持在申报前当面咨询卫生当局,包括就汇总策略以及提供数据集和 CRF 进行内容和格式交流
Steve 任职于制药行业超过 30 年,在监管事务方面的写作、咨询和项目领导方面拥有丰富的经验。他曾成功地从发现到批准和生命周期管理各个环节为数个项目提供支持,包括在超过 75 项的提交中担任重要角色,及在多宗个案中带领整个提交团队,监督从模块 1 直至模块 5 的所有文件、发布,以及传递到监管部门的过程。
Bowlby 博士在临床研究和药物开发行业拥有超过 25 年的经验。在过去的 10 年中,他领导了许多新药申请、生物制品许可申请和向美国食品药品监督管理局和欧洲药品管理局提交的研究性新药 (IND) 申请。Bowlby 博士领导了研究者手册 (IB)、临床研究报告 (CSR)、临床总结和概述、简报和其他监管文件的编写。在他职业生涯的早期,Bowlby 博士有计划地撰写了大量关于他在哈佛医学院的科学研究和博士后工作的生物医学手稿、海报和幻灯片。他的专业治疗领域包括眼科、神经病学、精神病学和慢性疼痛。Bowlby 博士对当前生物制药环境中使用的药物发现和开发方法有着专业的认识。
