清晰、简明的监管文件对任何药物开发项目的成功都至关重要。我们的高素质撰稿团队包括博士、药学博士和医学博士,涵盖药物开发过程的各个阶段。
听听我们客户的评价:
“您的最后评论和修正非常有价值,几乎所有评论和修正都已得到实施。您的团队在帮助我们准备要提交的模块方面确实发挥了出色的作用。它们现在看起来非常整洁一致。”–欧盟一家生物制药公司的体内药理学、毒理学和 DMPK 总监
在监管程序和医学写作方面具有可靠的成功记录
We provide services to author clinical, CMC (Chemistry, Manufacturing, and Controls), and nonclinical documents required throughout the full drug development lifecycle, including:
- Investigator Brochures (IBs) and updates
- 临床试验协议和修订
- Clinical Study Reports (CSRs)
- 简报文件、会议请求和信息请求
- All Common Technical Document (CTD) Modules 1, 2, 3, 4, and 5 components for Initial New Drug Applications (INDs), Marketing Authorization Applications (MAAs), and New Drug Applications (NDAs), to name a few.
- Pediatric Study Plans (PSP)/Pediatric investigational Plan (PIP)
- 患者叙述和安全报告
- Annual Reports, Development Safety Update Report (DSUR), and Periodic Benefit-Risk Evaluation Report (PBRER)
- 临床评估报告(CERs)
- Summaries of Clinical Trial Results for Laypersons (Plain Language Summaries), Informed Consents/Assents, and Clinical Trial Synopses for Laypersons
Are your documents ready for submission to major global regulatory agencies?
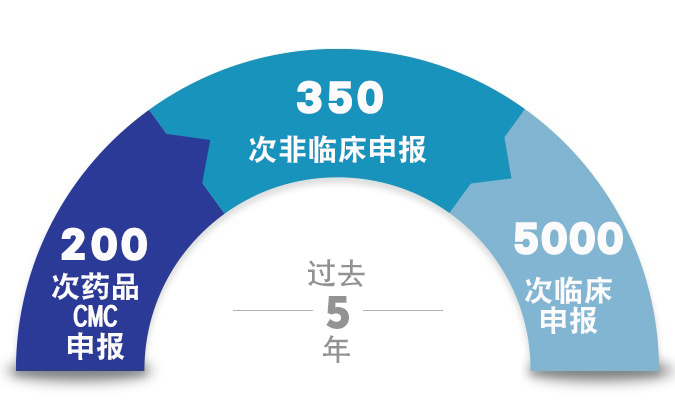
您的药物开发计划已经克服了许多挑战,需要大量投资才能实现这一目标。现在,您的提交文件在整个药物开发生命周期均需要医疗写作专业知识。Certara 为早期 IND、NDA 和 MAA 等需要 CMC、非临床和临床专业知识的监管申请提供专家咨询服务。最重要的是,您的递交计划需要 Certara 法规撰写团队提供的以技术为支撑的协调专业知识。
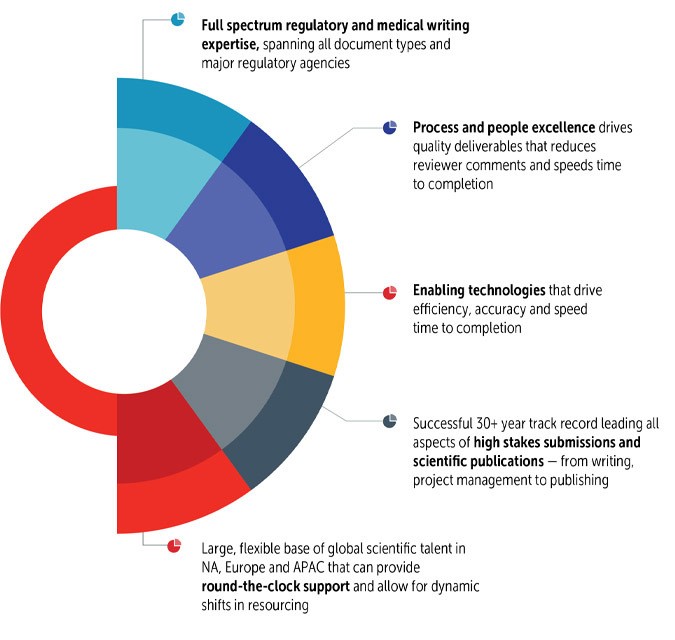
Certara 监管撰稿人是合作伙伴,可为所有提交文件类型提供深厚的技术和治疗专业知识,从而每次都能按时创建和交付成功的提交文件。
提供法规撰写服务,加快您的提交速度
我们的高素质撰稿人团队包括博士、医学博士、药学博士、科学家和护士,他们的背景横跨所有职能领域(文件质量、CMC、非临床、临床和监管),为全球最大的制药公司提供支持。业界一流的 SOP 可以提高质量,而专门的质量控制职能部门和一体化的写作团队则可以减少审稿人的评论并缩短完成时间。
作为重要的意见领袖,Certara 医学和法规撰稿人定期在 DIA 年度会议、AMWA 的医学撰写和交流会议以及 EMWA 的医学撰写会议等主要行业活动上发言。
监管作家加速实习期 (RWAR)
对于有兴趣成为监管作家的人来说,RWAR 是一个独特的机会。向在监管写作的各个学科拥有经证实的成功记录的团队学习。
在实习期间,同事们将开始为期两年的课程,该课程将教授领导监管写作项目所需的技能,同时提供更多浏览支持药物开发的文件的机会。作为一家服务机构,Certara 计划提供了一个机会,让学生在就业后的第一年内就能掌握直接与申办方合作所需的技能。我们的服务涵盖临床、非临床和药物警戒学科。
理想的候选人将有机会参加以导师为主导的培训计划,加快向领导规范性文件撰写工作的过渡。
