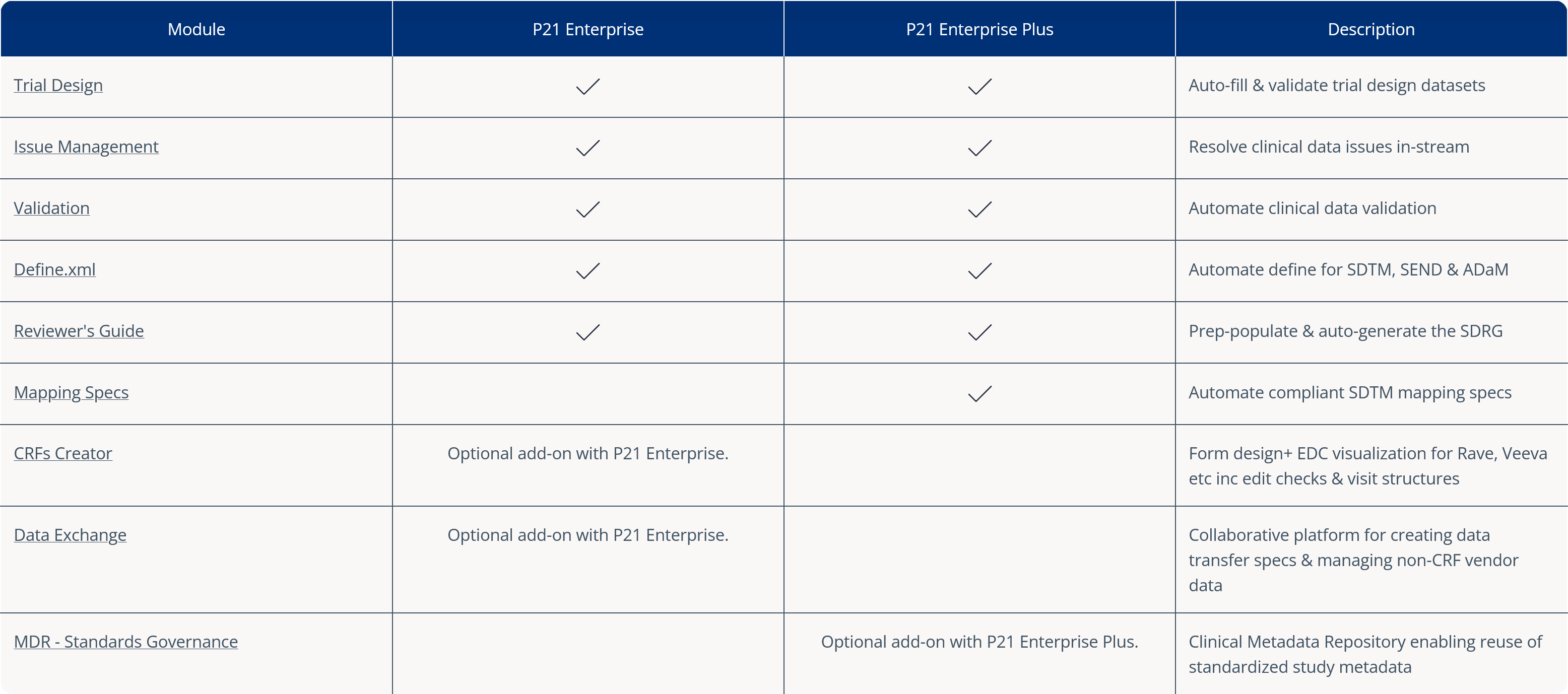
Pinnacle 21® Enterprise (P21E) revolutionizes the way you manage non-CRF data by providing a centralized, collaborative platform for managing external data.
随着 non-CRF 数据占临床试验数据比例超 70%,依赖电子表格与邮件沟通的传统人工方式已显低效。P21E 通过实时验证、协作式问题解决及透明化审计追踪功能,确保从外部供应商处获取高质量合规数据。